
|
Меню
|
 |
|
|
|
|
|
|

|
Реферат: Белки: история исследования, химсостав, свойства, биологические функции
|
 |
|
   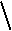 O O O O

        O O O O O O
O
  CH NHCOCH3 NHCOCH3
H3C CO – L-Ala – D-Glu – NH – CHCH2CH2CH2CHCO – D-Ala(CO) –
| |
COO – NH
|
Каждая С-концевая группа этого пептида, принадлежащая остатку D-аланина,
образует амидную связь с аминогруппой остатка диаминонимиелиновой кислоты,
принадлежащей соседней полисахаридной цепи.
Кроме вышеприведенной функции гликопротеиды участвуют в транспорте различных
веществ, в процессах свертывания крови, иммунитета, являются составными
частями слизи и секретов желудочно-кишечного тракта. У арктических рыб
гликопротеиды играют роль антифризов – веществ, препятствующих образованию
кристаллов льда внутри их организма.
Фосфопротеиды. Имеют в качестве небелкового компонента фосфорную к-ту.
Представителями данных белков являются казеиноген молока, вителлин (белок
желтков яиц), ихтулин (белок икры рыб). Такая локализация фосфопротеидов
свидетельствует о важном их значении для развивающегося организма. У взрослых
форм эти белки присутствуют в костной и нервной тканях.
Липопротеиды. Сложные белки, простетическая группа которых образована
липидами. По строению это небольшого размера (150-200 нм) сферические частицы,
наружная оболочка которых образована белками (что позволяет им передвигаться по
крови), а внутренняя часть – липидами и их производными. Основная функция
липопротеидов – транспорт по крови липидов. В зависимости от количества белка и
липидов, липопротеиды подразделяются на хиломикроны, липопротеиды низкой
плотности (ЛПНП) и высокой плотности (ЛПВП), которые иногда обозначаются как a-
и b-липопротеиды.
Хиломикроны являются наиболее крупными из липопротеидов и содержат до 98-99%
липидов и только 1-2% белка. Они образуются в слизистой оболочки кишечника и
обеспечивают транспорт липидов из кишечника в лимфу, а затем в кровь.
В ЛПНП количество белка составляет 9-20% , а среди липидов преобладают
холестерин и триацилглицерины (до 40%). Белковая часть ЛПВП колеблется в
пределах 35-50%, а белковая представлена фосфолипидами и холестерином. Таким
образом, холестерин транспортируется по крови в составе липопротеидов,
особенно ЛПНП.
Глава 7. Методы исследования белков
Среди методов, используемых в биохимии, ключевое значение имеют выделение
веществ из биологических источников и, как правило, их очистка с целью
получения индивидуальных соединений.
Следует отметить три главные проблемы выделения в индивидуальном виде
компонентов из живых организмов:
1) Исходный материал - биомасса состоит из многих сотен и даже тысяч
различных соединений. Разделение таких смесей чрезвычайно сложно, кроме того
многие компоненты этих смесей построены довольно однотипно (например,
иммуноглобулины). В связи с этим они мало различаются между собой по физико-
химическим характеристикам - растворимости или способности к сорбции на
определенном типе сорбента.
2) Работа с биохимическими объектами зачастую сопровождается
необходимостью манипулировать с очень небольшими количествами исходного
вещества. При ничтожно малом количестве используемого материала методы их
детекции должны быть высокочувствительными. Такими методами являются
спектрофотометрические методы, основанные на измерении поглощения видимого
или ультрафиолетового света, радиохимические методы, основанные на изменении
радиоактивности, и люминесцентные, основанные на изменении флуоресценции,
био- и хемилюминесценции.
3) Многие компоненты обладают очень низкой устойчивостью. Часто задача
состоит в том, чтобы выделить белок в нативном, т.е. сохраняющим
биологическую активность состоянии. Между тем многие белки при умеренных
температурах и незначительных изменениях рН среды подвержены денатурации,
которая обычно сопровождается потерей биологической активности -
инактивацией. Кроме того, в клетках часто имеются ферменты (в неповрежденных
клетках в лизосомах) способные разрушить те или иные вещества, в первую
очередь белки.
7.1. Традиционные методы выделения и очистки белков
Все методы разделения смесей основаны на том, что разделяемые компоненты в
результате каких-либо манипуляций оказываются в разных участках системы и
могут быть механически отделены друг от друга.
Выделение индивидуальных белков является ступенчатым процессом, т.к. на первых
этапах очистки фракции содержат множество примесей. На каждой ступени
разделения должна получаться фракция, более богатая необходимым веществом, чем
предыдущая. Такой процесс часто называют фракционированием.
На каждой стадии разделения белок находится либо в виде раствора, либо в виде
осадка.
1) Осаждение. Для осаждения необходимо понизить
каким-либо способом растворимость белка. Как уже говорилось в гл.5, стр.22
растворимость белка зависит от их способности к гидратации. У глобулярных
водорастворимых белков высокий уровень гидратации обеспечивается расположением
гидрофильных групп на поверхности. Добавление органических растворителей
понижает степень гидратации и приводит к осаждению белка. В качестве таких
растворителей используют ацетон. Осаждают белки также с помощью солей,
например, сульфата аммония. Принцип этого метода основан на том, что при
повышении концентрации соли в растворе происходит сжатие ионных атмосфер,
образуемых противоионами белка, что способствует сближению их до критического
расстояния, на котором межмолекулярные силы ван-дер-ваальсова притяжения
перевешивают кулоновские силы отталкивания противоионов. Это приводит к
слипанию белковых частиц и их выпадению в осадок.
2) Изоэлектрическое осаждение. Заряд белков
обусловлен в первую очередь остатками аспаратата и глутамата (отрицательный
заряд) и остатками лизина и аргинина (положительный заряд). По мере повышения
рН различными способами заряд белков проходит от положительных к отрицательным
значениям и в изоэлектрической точке оказывается равен нулю. В результате белок
лишается своей ионной атмосферы и его частицы слипаются, выпадая в осадок.
3) Центрифугирование. Выпавший осадок белка
можно выделить фильтрованием. Для этого часто пользуются центрифугами. Частицы
осажденного вещества под действием центробежной силы оседают на дне
центрифужных стаканов и сжимаются в плотный осадок, с которого оставшийся
раствор (надосадочная жидкость, или супернатант) легко сливается или
отсасывается. Скоростные центрифуги (ультрацентрифуги) создают центробежное
ускорение порядка 105g (т.е. 105 ускорений свободного
падения), что позволяет осаждать даже некоторые крупные надмолекулярные
агрегаты - рибосомы и вирусы.
4) Сорбция. Основана на различном сродстве
компонентов смесей к определенным веществам - сорбентам. Наиболее часто
используемый сорбент - гель фосфата кальция (гидроксиапатит) или активированный
уголь. Эффективную сорбцию можно получить на ионитах -
сорбентах, имеющих на поверхности заряженные группы. В исходном состоянии эти
заряды скомпенсированы какими-либо подвижными противоионами. Практически при
сорбции на ионитах происходит обмен этих противоионов. Если на поверхности
сорбента находятся отрицательно заряженные группы, то он связывает катионы и
его называют катионитом, соответственно сорбент с положительно заряженными
группами называют анионитом. В качестве ионитов чаще всего используют материалы
(после соответствующей химической обработки) на гидрофильной основе -
целлюлозе, декстране, силикагеле или пористых стеклах.
5) Ситовой эффект. Молекулярные сита
представляют собой материалы с очень маленькими порами определенного размера.
Следует отметить отличие этих “сит”: крупные частицы не остаются на поверхности
материала сита, а обтекают его частички (гранулы), тогда как мелкие вещества
примесей диффундируют в частицы сита и таким образом задерживаются. Материалом
для молекулярных сит может служить сефадекс (полисахарид декстран, у которого
после соответствующей обработки цепи оказываются сшитыми трехуглеродными
мостиками) или полиакриламид, линейные цепи которого сшиты метиленовыми
мостиками.
В перечисленных методах в конечной смеси остаются вспомогательные
низкомолекулярные вещества - органические растворители, соли и кислоты. Для
очищения от них используется метод диализа, упоминавшийся в
главе “Свойства белков”. Диализ основан на применении мембран проницаемых для
воды и низкомолекулярных веществ и непроницаемых для белков. Чаще всего с этой
целью используют пленки из целлофана (нитрат целлюлозы). В лаборатории
подлежащий диализу раствор белка помещают в мешок из целлофана и погружаю
последний в сосуд с водой. Непрерывный ток воды через сосуд приводит к полному
переходу в него всех проходящих через целлофан веществ, а белки остаются внутри
(см. иллюстрацию к гл.5).
7.2. Методы зонального разделения
Эти методы основаны на том, что создается некоторая система, в которой
компоненты смеси перемещаются с различными скоростями. Если в такую систему
ввести разделяемую смесь в виде некоторой зоны, то по мере ее перемещения
компоненты смеси, движущиеся с разными скоростями, будут формировать
отдельные зоны, которые затем можно разнести в разные приемники.
1) Хроматография. При разделении белков и их анализе
используется жидкостная хроматография. В жидкостной хроматографии зона
разделяемых веществ с помощью тока элюирующей (вымывающей) жидкости
перемещается относительно неподвижной фазы, которая обладает разным сродством к
разделяемым компонентам. При перемещении зоны с помощью тока элюента каждый из
разделяемых компонентов проводит некоторую часть времени на неподвижной фазе.
Чем больше это время, тем медленнее перемещается зона с разделяемой смесью.
В зависимости от природы физико-химического явления, лежащего в основе
разделения веществ, различают адсорбционную, ионообменную,
распределительную и гель-хроматографию (эксклюзивную хроматографию). В
адсорбционной чаще всего используют оксид алюминия в качестве неподвижной фазы.
В ионообменной используются те же типы ионитов, что в ионообменной сорбции.
Распределительная хроматогрфия основана на разделении веществ между двумя
несмешивающимися жидкими фазами. Неподвижная жидкая фаза образуется в
результате ее закрепления на пористом нерастворимом носителе. В гель
2) Электрофорез. В этом случае зоны создаются в
результате того, что разные компоненты смеси с различной скоростью перемещаются
в электрическом поле. После специальной обработки разделяемые смеси наносят на
гель (декстроновый, полиакриламидный, или другой) а затем подключают но
определенное время постоянный электрический ток. Белки в зависимости от своей
молекулярной массы и заряда начинают двигаться с различной скоростью. После
отключения тока гель помещают в специальный раствор, где интересующие
исследователя белки окрашиваются. Существует электрофорез в растворе, но он
имеет ограниченное применение, т.к. исследуемые белки часто подвергаются
значительному диффузионному размыванию. Однако сейчас стало возможным применять
этот метод в условиях невесомости в космосе, что устраняет конвекционные токи,
обуславливающие диффузионную размывку.
Все описанные выше методы зонального разделения являются одномерными, разделение
в них происходит в одной координате. Наряду с этим применяются двумерные
системы разделения на пластинах. При этом разделяемую смесь в виде пятна
наносят на один из углов и разделяют в одном направлении. Затем какие-либо
параметры, определяющие разделяющую способность системы изменяют и проводят
разделение в перпендикулярном направлении. При удачном подборе системы и
условий разделения удается разделить те компоненты, которые не разделились при
первой процедуре. Комбинации методов могут быть довольно разнообразны:
двумерная хроматография с использованием в разных направлениях разных элюентов,
хроматография в одном и электрофорез в другом направлениях.
7.3. Определение первичной структуры белков
Определение первичной структуры белков сводится к выяснению порядка расположения
аминокислот в полипептидной цепочке. Эту задачу решают с помощью метода
секвенирования (от англ. sequence - последовательность).
Собственно секвенирование на его сегодняшнем уровне позволяет определить
аминокислотную последовательность а полипептидах, размер которых не превышает
несколько десятков аминокислотных остатков. В то же время исследуемые
полипептидные фрагменты значительно короче тех природных белков, с которыми
приходится иметь дело. Поэтому необходимо предварительное разрезание
исходного полипептида на короткие фрагменты. После секвенирования полученных
фрагментов их необходимо снова сшить в первоначальной последовательности.
Таким образом определение первичной последовательности белка сводится к
следующим основным этапам:
1) Расщепление белка на несколько фрагментов длиной, доступной для
секвенирования.
2) Секвенирование каждого из полученных фрагментов.
3) Сборка полной структуры белка из установленных структур его фрагментов.
Для специфического расщепления белков по определенным точкам применяются как
ферментативные, так и химические методы. Из ферментов, катализирующих
гидролиз белков по определенным точкам, наиболее широко используют трипсин и
химотрипсин. Трипсин катализирует гидролиз пептидных связей, расположенных
после остатков лизина и аргинина. Химотрипсин преимущественно расщепляет
белки после остатков ароматических аминокислот - фенилаланина, тирозина и
триптофана. При необходимости специфичность трипсина может быть повышена или
изменена. Например, обработка цитраконовым ангидридом исследуемого белка
приводит к ацилированию остатков лизина. В таком модифицированном белке
расщепление будет проходить только по остаткам аргинина.
Наряду с ферментативными методами используются и химические методы
расщепления белков. Для этой цели часто применяют бромциан, расщепляющий
белок по остаткам метионина: CH NHCOCH3 NHCOCH3
H3C CO – L-Ala – D-Glu – NH – CHCH2CH2CH2CHCO – D-Ala(CO) –
| |
COO – NH
|
Каждая С-концевая группа этого пептида, принадлежащая остатку D-аланина,
образует амидную связь с аминогруппой остатка диаминонимиелиновой кислоты,
принадлежащей соседней полисахаридной цепи.
Кроме вышеприведенной функции гликопротеиды участвуют в транспорте различных
веществ, в процессах свертывания крови, иммунитета, являются составными
частями слизи и секретов желудочно-кишечного тракта. У арктических рыб
гликопротеиды играют роль антифризов – веществ, препятствующих образованию
кристаллов льда внутри их организма.
Фосфопротеиды. Имеют в качестве небелкового компонента фосфорную к-ту.
Представителями данных белков являются казеиноген молока, вителлин (белок
желтков яиц), ихтулин (белок икры рыб). Такая локализация фосфопротеидов
свидетельствует о важном их значении для развивающегося организма. У взрослых
форм эти белки присутствуют в костной и нервной тканях.
Липопротеиды. Сложные белки, простетическая группа которых образована
липидами. По строению это небольшого размера (150-200 нм) сферические частицы,
наружная оболочка которых образована белками (что позволяет им передвигаться по
крови), а внутренняя часть – липидами и их производными. Основная функция
липопротеидов – транспорт по крови липидов. В зависимости от количества белка и
липидов, липопротеиды подразделяются на хиломикроны, липопротеиды низкой
плотности (ЛПНП) и высокой плотности (ЛПВП), которые иногда обозначаются как a-
и b-липопротеиды.
Хиломикроны являются наиболее крупными из липопротеидов и содержат до 98-99%
липидов и только 1-2% белка. Они образуются в слизистой оболочки кишечника и
обеспечивают транспорт липидов из кишечника в лимфу, а затем в кровь.
В ЛПНП количество белка составляет 9-20% , а среди липидов преобладают
холестерин и триацилглицерины (до 40%). Белковая часть ЛПВП колеблется в
пределах 35-50%, а белковая представлена фосфолипидами и холестерином. Таким
образом, холестерин транспортируется по крови в составе липопротеидов,
особенно ЛПНП.
Глава 7. Методы исследования белков
Среди методов, используемых в биохимии, ключевое значение имеют выделение
веществ из биологических источников и, как правило, их очистка с целью
получения индивидуальных соединений.
Следует отметить три главные проблемы выделения в индивидуальном виде
компонентов из живых организмов:
1) Исходный материал - биомасса состоит из многих сотен и даже тысяч
различных соединений. Разделение таких смесей чрезвычайно сложно, кроме того
многие компоненты этих смесей построены довольно однотипно (например,
иммуноглобулины). В связи с этим они мало различаются между собой по физико-
химическим характеристикам - растворимости или способности к сорбции на
определенном типе сорбента.
2) Работа с биохимическими объектами зачастую сопровождается
необходимостью манипулировать с очень небольшими количествами исходного
вещества. При ничтожно малом количестве используемого материала методы их
детекции должны быть высокочувствительными. Такими методами являются
спектрофотометрические методы, основанные на измерении поглощения видимого
или ультрафиолетового света, радиохимические методы, основанные на изменении
радиоактивности, и люминесцентные, основанные на изменении флуоресценции,
био- и хемилюминесценции.
3) Многие компоненты обладают очень низкой устойчивостью. Часто задача
состоит в том, чтобы выделить белок в нативном, т.е. сохраняющим
биологическую активность состоянии. Между тем многие белки при умеренных
температурах и незначительных изменениях рН среды подвержены денатурации,
которая обычно сопровождается потерей биологической активности -
инактивацией. Кроме того, в клетках часто имеются ферменты (в неповрежденных
клетках в лизосомах) способные разрушить те или иные вещества, в первую
очередь белки.
7.1. Традиционные методы выделения и очистки белков
Все методы разделения смесей основаны на том, что разделяемые компоненты в
результате каких-либо манипуляций оказываются в разных участках системы и
могут быть механически отделены друг от друга.
Выделение индивидуальных белков является ступенчатым процессом, т.к. на первых
этапах очистки фракции содержат множество примесей. На каждой ступени
разделения должна получаться фракция, более богатая необходимым веществом, чем
предыдущая. Такой процесс часто называют фракционированием.
На каждой стадии разделения белок находится либо в виде раствора, либо в виде
осадка.
1) Осаждение. Для осаждения необходимо понизить
каким-либо способом растворимость белка. Как уже говорилось в гл.5, стр.22
растворимость белка зависит от их способности к гидратации. У глобулярных
водорастворимых белков высокий уровень гидратации обеспечивается расположением
гидрофильных групп на поверхности. Добавление органических растворителей
понижает степень гидратации и приводит к осаждению белка. В качестве таких
растворителей используют ацетон. Осаждают белки также с помощью солей,
например, сульфата аммония. Принцип этого метода основан на том, что при
повышении концентрации соли в растворе происходит сжатие ионных атмосфер,
образуемых противоионами белка, что способствует сближению их до критического
расстояния, на котором межмолекулярные силы ван-дер-ваальсова притяжения
перевешивают кулоновские силы отталкивания противоионов. Это приводит к
слипанию белковых частиц и их выпадению в осадок.
2) Изоэлектрическое осаждение. Заряд белков
обусловлен в первую очередь остатками аспаратата и глутамата (отрицательный
заряд) и остатками лизина и аргинина (положительный заряд). По мере повышения
рН различными способами заряд белков проходит от положительных к отрицательным
значениям и в изоэлектрической точке оказывается равен нулю. В результате белок
лишается своей ионной атмосферы и его частицы слипаются, выпадая в осадок.
3) Центрифугирование. Выпавший осадок белка
можно выделить фильтрованием. Для этого часто пользуются центрифугами. Частицы
осажденного вещества под действием центробежной силы оседают на дне
центрифужных стаканов и сжимаются в плотный осадок, с которого оставшийся
раствор (надосадочная жидкость, или супернатант) легко сливается или
отсасывается. Скоростные центрифуги (ультрацентрифуги) создают центробежное
ускорение порядка 105g (т.е. 105 ускорений свободного
падения), что позволяет осаждать даже некоторые крупные надмолекулярные
агрегаты - рибосомы и вирусы.
4) Сорбция. Основана на различном сродстве
компонентов смесей к определенным веществам - сорбентам. Наиболее часто
используемый сорбент - гель фосфата кальция (гидроксиапатит) или активированный
уголь. Эффективную сорбцию можно получить на ионитах -
сорбентах, имеющих на поверхности заряженные группы. В исходном состоянии эти
заряды скомпенсированы какими-либо подвижными противоионами. Практически при
сорбции на ионитах происходит обмен этих противоионов. Если на поверхности
сорбента находятся отрицательно заряженные группы, то он связывает катионы и
его называют катионитом, соответственно сорбент с положительно заряженными
группами называют анионитом. В качестве ионитов чаще всего используют материалы
(после соответствующей химической обработки) на гидрофильной основе -
целлюлозе, декстране, силикагеле или пористых стеклах.
5) Ситовой эффект. Молекулярные сита
представляют собой материалы с очень маленькими порами определенного размера.
Следует отметить отличие этих “сит”: крупные частицы не остаются на поверхности
материала сита, а обтекают его частички (гранулы), тогда как мелкие вещества
примесей диффундируют в частицы сита и таким образом задерживаются. Материалом
для молекулярных сит может служить сефадекс (полисахарид декстран, у которого
после соответствующей обработки цепи оказываются сшитыми трехуглеродными
мостиками) или полиакриламид, линейные цепи которого сшиты метиленовыми
мостиками.
В перечисленных методах в конечной смеси остаются вспомогательные
низкомолекулярные вещества - органические растворители, соли и кислоты. Для
очищения от них используется метод диализа, упоминавшийся в
главе “Свойства белков”. Диализ основан на применении мембран проницаемых для
воды и низкомолекулярных веществ и непроницаемых для белков. Чаще всего с этой
целью используют пленки из целлофана (нитрат целлюлозы). В лаборатории
подлежащий диализу раствор белка помещают в мешок из целлофана и погружаю
последний в сосуд с водой. Непрерывный ток воды через сосуд приводит к полному
переходу в него всех проходящих через целлофан веществ, а белки остаются внутри
(см. иллюстрацию к гл.5).
7.2. Методы зонального разделения
Эти методы основаны на том, что создается некоторая система, в которой
компоненты смеси перемещаются с различными скоростями. Если в такую систему
ввести разделяемую смесь в виде некоторой зоны, то по мере ее перемещения
компоненты смеси, движущиеся с разными скоростями, будут формировать
отдельные зоны, которые затем можно разнести в разные приемники.
1) Хроматография. При разделении белков и их анализе
используется жидкостная хроматография. В жидкостной хроматографии зона
разделяемых веществ с помощью тока элюирующей (вымывающей) жидкости
перемещается относительно неподвижной фазы, которая обладает разным сродством к
разделяемым компонентам. При перемещении зоны с помощью тока элюента каждый из
разделяемых компонентов проводит некоторую часть времени на неподвижной фазе.
Чем больше это время, тем медленнее перемещается зона с разделяемой смесью.
В зависимости от природы физико-химического явления, лежащего в основе
разделения веществ, различают адсорбционную, ионообменную,
распределительную и гель-хроматографию (эксклюзивную хроматографию). В
адсорбционной чаще всего используют оксид алюминия в качестве неподвижной фазы.
В ионообменной используются те же типы ионитов, что в ионообменной сорбции.
Распределительная хроматогрфия основана на разделении веществ между двумя
несмешивающимися жидкими фазами. Неподвижная жидкая фаза образуется в
результате ее закрепления на пористом нерастворимом носителе. В гель
2) Электрофорез. В этом случае зоны создаются в
результате того, что разные компоненты смеси с различной скоростью перемещаются
в электрическом поле. После специальной обработки разделяемые смеси наносят на
гель (декстроновый, полиакриламидный, или другой) а затем подключают но
определенное время постоянный электрический ток. Белки в зависимости от своей
молекулярной массы и заряда начинают двигаться с различной скоростью. После
отключения тока гель помещают в специальный раствор, где интересующие
исследователя белки окрашиваются. Существует электрофорез в растворе, но он
имеет ограниченное применение, т.к. исследуемые белки часто подвергаются
значительному диффузионному размыванию. Однако сейчас стало возможным применять
этот метод в условиях невесомости в космосе, что устраняет конвекционные токи,
обуславливающие диффузионную размывку.
Все описанные выше методы зонального разделения являются одномерными, разделение
в них происходит в одной координате. Наряду с этим применяются двумерные
системы разделения на пластинах. При этом разделяемую смесь в виде пятна
наносят на один из углов и разделяют в одном направлении. Затем какие-либо
параметры, определяющие разделяющую способность системы изменяют и проводят
разделение в перпендикулярном направлении. При удачном подборе системы и
условий разделения удается разделить те компоненты, которые не разделились при
первой процедуре. Комбинации методов могут быть довольно разнообразны:
двумерная хроматография с использованием в разных направлениях разных элюентов,
хроматография в одном и электрофорез в другом направлениях.
7.3. Определение первичной структуры белков
Определение первичной структуры белков сводится к выяснению порядка расположения
аминокислот в полипептидной цепочке. Эту задачу решают с помощью метода
секвенирования (от англ. sequence - последовательность).
Собственно секвенирование на его сегодняшнем уровне позволяет определить
аминокислотную последовательность а полипептидах, размер которых не превышает
несколько десятков аминокислотных остатков. В то же время исследуемые
полипептидные фрагменты значительно короче тех природных белков, с которыми
приходится иметь дело. Поэтому необходимо предварительное разрезание
исходного полипептида на короткие фрагменты. После секвенирования полученных
фрагментов их необходимо снова сшить в первоначальной последовательности.
Таким образом определение первичной последовательности белка сводится к
следующим основным этапам:
1) Расщепление белка на несколько фрагментов длиной, доступной для
секвенирования.
2) Секвенирование каждого из полученных фрагментов.
3) Сборка полной структуры белка из установленных структур его фрагментов.
Для специфического расщепления белков по определенным точкам применяются как
ферментативные, так и химические методы. Из ферментов, катализирующих
гидролиз белков по определенным точкам, наиболее широко используют трипсин и
химотрипсин. Трипсин катализирует гидролиз пептидных связей, расположенных
после остатков лизина и аргинина. Химотрипсин преимущественно расщепляет
белки после остатков ароматических аминокислот - фенилаланина, тирозина и
триптофана. При необходимости специфичность трипсина может быть повышена или
изменена. Например, обработка цитраконовым ангидридом исследуемого белка
приводит к ацилированию остатков лизина. В таком модифицированном белке
расщепление будет проходить только по остаткам аргинина.
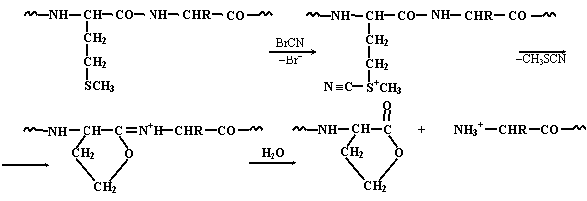
Наряду с ферментативными методами используются и химические методы
расщепления белков. Для этой цели часто применяют бромциан, расщепляющий
белок по остаткам метионина:
|
Страницы: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11
|
|
|
|

|
НОВОСТИ
|

|
|
|
|
|
|
|
|
|
|
|
|
© 2000-2013
Рефераты, доклады, курсовые работы, рефераты релиния, рефераты анатомия, рефераты маркетинг, рефераты бесплатно, реферат, рефераты скачать, научные работы, рефераты литература, рефераты кулинария, рефераты медицина, рефераты биология, рефераты социология, большая бибилиотека рефератов, реферат бесплатно, рефераты право, рефераты авиация, рефераты психология, рефераты математика, курсовые работы, реферат, доклады, рефераты, рефераты скачать, рефераты на тему, сочинения, курсовые, рефераты логистика, дипломы, рефераты менеджемент и многое другое.
|
|
Все права защищены.
|
|


