Ca Ca
COO – COO –
NH3+ R R NH3+
L-изомер D-изомер
В состав всех изученных в настоящее время белков входят только аминокислоты
L-ряда, у которых, если рассматривать хиральный атом со стороны атома H, группы
NH3+, COO- и радикал R расположены по часовой
стрелке. Необходимость при построении биологически значимой полимерной молекулы
строить ее из строго определенного энантиомера очевидна – из рацемической
смеси двух энантиомеров получилась бы невообразимо сложная смесь
диастереоизомеров. Вопрос, почему жизнь на Земле основана на белках, построеных
именно из L-, а не D-a-аминокислот, до сих пор остается интригующей загадкой.
Следует отметить, что D-аминокислоты достаточно широко распространены в живой
природе и, более того, входят в состав биологически значимых олигопептидов.
Из двадцати основных a-аминокислот строятся белки, однако остальные, достаточно
разнообразные аминокислоты образуются из этих 20 аминокислотных остатков уже в
составе белковой молекулы. Среди таких превращений следует в первую очередь
отметить образование дисульфидных мостиков при окислении двух
остатков цистеина в составе уже сформированных пептидных цепей. В результате
образуется из двух остатков цистеина остаток диаминодикарбоновой кислоты
цистина (см. Приложение I). При этом возникает сшивка либо внутри одной
полипептидной цепи, либо между двумя различными цепями. В качестве небольшого
белка, имеющего две полипептидные цепи, соединенный дисульфидными мостиками, а
также сшивки внутри одной из полипептидных цепей:
| | Ca Ca
COO – COO –
NH3+ R R NH3+
L-изомер D-изомер
В состав всех изученных в настоящее время белков входят только аминокислоты
L-ряда, у которых, если рассматривать хиральный атом со стороны атома H, группы
NH3+, COO- и радикал R расположены по часовой
стрелке. Необходимость при построении биологически значимой полимерной молекулы
строить ее из строго определенного энантиомера очевидна – из рацемической
смеси двух энантиомеров получилась бы невообразимо сложная смесь
диастереоизомеров. Вопрос, почему жизнь на Земле основана на белках, построеных
именно из L-, а не D-a-аминокислот, до сих пор остается интригующей загадкой.
Следует отметить, что D-аминокислоты достаточно широко распространены в живой
природе и, более того, входят в состав биологически значимых олигопептидов.
Из двадцати основных a-аминокислот строятся белки, однако остальные, достаточно
разнообразные аминокислоты образуются из этих 20 аминокислотных остатков уже в
составе белковой молекулы. Среди таких превращений следует в первую очередь
отметить образование дисульфидных мостиков при окислении двух
остатков цистеина в составе уже сформированных пептидных цепей. В результате
образуется из двух остатков цистеина остаток диаминодикарбоновой кислоты
цистина (см. Приложение I). При этом возникает сшивка либо внутри одной
полипептидной цепи, либо между двумя различными цепями. В качестве небольшого
белка, имеющего две полипептидные цепи, соединенный дисульфидными мостиками, а
также сшивки внутри одной из полипептидных цепей:
| |
GIVEQCCASVCSLYQLENYCN
| |
FVNQHLCGSHLVEALYLVCGERGFFYTPKA
Важным примером модификации аминокислотных остатков является превращение
остатков пролина в остатки гидроксипролина:
 
   N – CH – CO – N – CH – CO – N – CH – CO – N – CH – CO –
 CH2 CH2 CH2 CH2
CH2 CHOH
Это превращение происходит, причем в значительном масштабе, при образовании
важного белкового компонента соединительной ткани – коллагена.
Еще одним весьма важным видом модификации белков является фосфорилирование
гидроксогрупп остатков серина, треонина и тирозина, например: CH2 CH2 CH2 CH2
CH2 CHOH
Это превращение происходит, причем в значительном масштабе, при образовании
важного белкового компонента соединительной ткани – коллагена.
Еще одним весьма важным видом модификации белков является фосфорилирование
гидроксогрупп остатков серина, треонина и тирозина, например:
 – NH – CH – CO – – NH – CH – CO –
| |
CH2OH CH2OPO32 –
Аминокислоты в водном растворе находятся в ионизированном состоянии за счет
диссоциации амино- и карбоксильных групп, входящих в состав радикалов.
Другими словами, они являются амфотерными соединениями и могут существовать
либо как кислоты (доноры протонов), либо как основания (акцепторы доноров).
Все аминокислоты в зависимости от структуры разделены на несколько групп:
Ациклические. Моноаминомонокарбоновые аминокислоты имеют в своем
составе одну аминную и одну карбоксильную группы, в водном растворе они
нейтральны. Некоторые из них имеют общие структурные особенности, что позволяет
рассматривать их вместе:
1. Глицин и аланин. Глицин (гликокол или аминоуксусная к-та) является
оптически неактивным – это единственная аминокислота, не имеющая энатиомеров.
Глицин участвует в образовании нуклеиновых и желчных к-т, гема, необходим для
обезвреживания в печени токсичных продуктов. Аланин используется организмом в
различных процессах обмена углеводов и энергии. Его изомер b-аланин является
составной частью витамина пантотеновой к-ты, коэнзима А (КоА), экстрактивных
веществ мышц.
2. Серин и треонин. Они относятся к группе гидрооксикислот, т.к.
имеют гидроксильную группу. Серин входит в состав различных ферментов,
основного белка молока – казеина, а также в состав многих липопротеинов.
Треонин участвует в биосинтезе белка, являясь незаменимой аминокислотой.
3. Цистеин и метионин. Аминокислоты, имеющие в составе атом
серы. Значение цистеина определяется наличием в ее составе сульфгидрильной ( –
SH) группы, которая придает ему способность легко окисляться и защищать
организм о веществ с высокой окислительной способностью (при лучевом поражении,
отравлении фосфором). Метионин характеризуется наличием легко подвижной
метильной группы, использующейся для синтеза важных соединений в организме
(холина, креатина, тимина, адреналина и др.)
4. Валин, лейцин и изолейцин. Представляют собой разветвленные
аминокислоты, которые активно участвуют в обмене веществ и не синтезируются в
организме.
Моноаминодикарбоновые аминокислоты имеют одну аминную и две карбоксильные
группы и в водном растворе дают кислую реакцию. К ним относятся аспарагиновая и
глутаминовая к-ты, аспарагин и глутамин. Они входят в состав тормозных
медиаторов нервной системы.
Диаминомонокарбоновые аминокислоты в водном растворе имеют щелочную
реакцию за сет наличия двух аминных групп. Относящийся к ним лизин необходим
для синтеза гистонов а также в ряд ферментов. Аргинин участвует в синтезе
мочевины, креатина.
Циклические. Эти аминокислоты имеют в своем составе ароматическое или
гетероциклическое ядро и, как правило, не синтезируется в организме человека и
должны поступать с пищей. Они активно участвуют в разнообразных обменных
процессах. Так фенил-аланин служит основным источником синтеза тирозина –
предшественника ряда биологически важных веществ: гормонов (тироксина,
адреналина), некоторых пигментов. Триптофан помимо участия в синтезе белка,
служит компонентом витамина PP, серотонина, триптамина, ряда пигментов.
Гистидин необходим для синтеза белков, является предшественником гистамина,
влияющего на кровяное давление и секрецию желудочного сока.
Глава 4. Структура.
При изучении состава белков было установлено, что все они построены по единому
принципу и имеют четыре уровня организации: первичную, вторичную,
третичную, а отдельные из них и четвертичную структуры. – NH – CH – CO – – NH – CH – CO –
| |
CH2OH CH2OPO32 –
Аминокислоты в водном растворе находятся в ионизированном состоянии за счет
диссоциации амино- и карбоксильных групп, входящих в состав радикалов.
Другими словами, они являются амфотерными соединениями и могут существовать
либо как кислоты (доноры протонов), либо как основания (акцепторы доноров).
Все аминокислоты в зависимости от структуры разделены на несколько групп:
Ациклические. Моноаминомонокарбоновые аминокислоты имеют в своем
составе одну аминную и одну карбоксильную группы, в водном растворе они
нейтральны. Некоторые из них имеют общие структурные особенности, что позволяет
рассматривать их вместе:
1. Глицин и аланин. Глицин (гликокол или аминоуксусная к-та) является
оптически неактивным – это единственная аминокислота, не имеющая энатиомеров.
Глицин участвует в образовании нуклеиновых и желчных к-т, гема, необходим для
обезвреживания в печени токсичных продуктов. Аланин используется организмом в
различных процессах обмена углеводов и энергии. Его изомер b-аланин является
составной частью витамина пантотеновой к-ты, коэнзима А (КоА), экстрактивных
веществ мышц.
2. Серин и треонин. Они относятся к группе гидрооксикислот, т.к.
имеют гидроксильную группу. Серин входит в состав различных ферментов,
основного белка молока – казеина, а также в состав многих липопротеинов.
Треонин участвует в биосинтезе белка, являясь незаменимой аминокислотой.
3. Цистеин и метионин. Аминокислоты, имеющие в составе атом
серы. Значение цистеина определяется наличием в ее составе сульфгидрильной ( –
SH) группы, которая придает ему способность легко окисляться и защищать
организм о веществ с высокой окислительной способностью (при лучевом поражении,
отравлении фосфором). Метионин характеризуется наличием легко подвижной
метильной группы, использующейся для синтеза важных соединений в организме
(холина, креатина, тимина, адреналина и др.)
4. Валин, лейцин и изолейцин. Представляют собой разветвленные
аминокислоты, которые активно участвуют в обмене веществ и не синтезируются в
организме.
Моноаминодикарбоновые аминокислоты имеют одну аминную и две карбоксильные
группы и в водном растворе дают кислую реакцию. К ним относятся аспарагиновая и
глутаминовая к-ты, аспарагин и глутамин. Они входят в состав тормозных
медиаторов нервной системы.
Диаминомонокарбоновые аминокислоты в водном растворе имеют щелочную
реакцию за сет наличия двух аминных групп. Относящийся к ним лизин необходим
для синтеза гистонов а также в ряд ферментов. Аргинин участвует в синтезе
мочевины, креатина.
Циклические. Эти аминокислоты имеют в своем составе ароматическое или
гетероциклическое ядро и, как правило, не синтезируется в организме человека и
должны поступать с пищей. Они активно участвуют в разнообразных обменных
процессах. Так фенил-аланин служит основным источником синтеза тирозина –
предшественника ряда биологически важных веществ: гормонов (тироксина,
адреналина), некоторых пигментов. Триптофан помимо участия в синтезе белка,
служит компонентом витамина PP, серотонина, триптамина, ряда пигментов.
Гистидин необходим для синтеза белков, является предшественником гистамина,
влияющего на кровяное давление и секрецию желудочного сока.
Глава 4. Структура.
При изучении состава белков было установлено, что все они построены по единому
принципу и имеют четыре уровня организации: первичную, вторичную,
третичную, а отдельные из них и четвертичную структуры.
4.1. Первичная структура
Представляет собой линейную цепь аминокислот, расположенных в определенной
последовательности и соединенных между собой пептидными связями.
Пептидная связь образуется за счет a-карбоксильной группы одной
аминокислоты и a-аминной группы другой:
   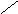 O - H2O
O
O - H2O
O
 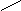 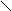 H2N – CH – C + NH – CH – COOH H2
N – CH – C ¾ NH – CH – COOH
| OH H |
| |
R R1
R R
H2N – CH – C + NH – CH – COOH H2
N – CH – C ¾ NH – CH – COOH
| OH H |
| |
R R1
R R
Страницы: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11
|