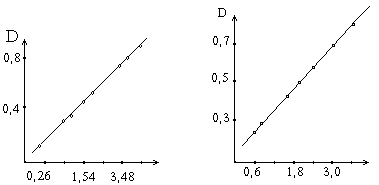|
фермента на разных стадиях очистки необходимо строго соблюдать одни и те же
условия. Желательно не ограничиваться определением активности по одному
какому-либо методу. Количество субстрата, превращаемого в условиях теста по
определению активности фермента, должно быть пропорционально количеству
последнего и времени инкубирования. Если же нет такой пропорциональности, то
активность рассчитывают по предварительно построенному калибровочному графику,
отражающему зависимость скорости реакции от количества единиц фермента. Когда
ход реакции нелинеен во времени, следует определять начальную скорость реакции
(по тангенсу угла наклона касательной к начальному отрезку кривой превращения).
Для этого легче всего применять такие методы изменения активности, которые
позволяют непрерывно следить за ходом превращения во времени:
спектрофотометрические методы, потенциометрические, полярографические и т.п.
Для измерения скорости ферментативной реакции необходимо выбрать буфер, который
не тормозит исследуемую активность и обеспечивает поддержание рН раствора,
близкой к оптимальной для данного фермента. Реакцию проводят при температуре,
лежащей в большинстве случаев в пределах 25-400С. При исследовании
ферментов, требующих присутствия кофакторов (ионов металлов, коферментов и
др.), концентрация которых может снижаться по мере очистки фермента, в
реакционную смесь следует добавлять недостающие кофакторы, например соли
металлов, АТФ, НАДФ и т.п. Также для определения активности ферментов вводят
стабилизаторы в состав опытных смесей. Во многих случаях добавление желатина,
альбумина и других добавок предотвращает денатурацию ферментного белка.
Спектрофотометрические методы. Спектрофотометрические методы основаны на
поглощении света в определенных участках спектра многими соединениями,
являющимися активными группами ферментов, субстратами или продуктами реакции.
Положение максимума поглощения при определенной длине волны определяется
наличием в исследуемом материале определенных групп - аналитических форм. Для
измерения спектров используют специальные приборы - спектрофотометры,
фотометрические абсорбциометры и др. Этот метод отличается высокой
чувствительностью, быстротой определения, малым расходованием фермента и
реактивов и позволяет следить за течением реакции во времени. Для этого
реакционную смесь помещают в кювету, вставленную в термостатируемый
кюветодержатель. Через малый промежуток времени после добавления фермента (или
субстрата) и быстрого перемешивания измеряют поглощение при длине волны,
характерной для используемого субстрата или конечного продукта, образующегося в
данной реакции. С помощью спектрофотометрического метода можно измерять
непосредственно концентрацию некоторых ферментов (после достаточной очистки) по
величине характерных максимумов поглощения прочно связанных коферментов
(простетических групп). Необходимо иметь произвольно выбранную единицу
фермента, с помощью которой можно было бы количественно выразить чистоту и
активность различных фракций. В большинстве случаев выбор единицы зависит от
избираемого метода определения. В случае спектрофотометрического метода такой
единицей может служить количество фермента, которое вызывает определенное
изменение в оптической плотности за определенное время при данных условиях
опыта; если определяется продукт реакции, то единицей будет количество
фермента, которое вызывает образование определенного количества вещества в
минуту, и т.д. Тогда удельную активность фермента, которая является мерилом
чистоты ферментного препарата, выражают числом единиц в 1 мг вещества (белка).
Для целей определения ферментов могут быть использованы не только измерение
поглощения света, но также измерения флюоресценции - спектрофлюорометрические
методы. Такое определение активности фермента в ряде случаев по
чувствительности превосходит спектрофотометрические методы на целый порядок
величины. Некоторые коферменты и субстраты обладают сильной флюоресценцией.
НАД и НАДФ в восстановленном состоянии имеют сильную флюоресценцию и не
флюоресцируют в окисленном состоянии. Поэтому спектрофлюорометрию используют
для изучения кинетики и механизма действия никотинамидных и флавиновых
ферментов.
Колориметрические (фотометрические) методы. В основе этих методов лежит
измерение при помощи визуального или фотоэлектрического колориметра окрашенного
продукта, образующегося при взаимодействии субстрата или продукта действия
фермента со специфическими реактивами, которые обычно добавляются в
фиксированную опытную пробу, взятую после остановки ферментативной реакции. Эти
методы весьма разнообразны. Разработаны количественные методы, основанные на
биуретовой реакции, при которой состав белка, очевидно не должен сказываться на
результатах определения, т.к. эта реакция на пептидные связи, а не на боковые
группы в белке. Метод Горнелла и соавторов, основанный на измерении полосы
поглощения в области 550-650 нм, используется для определения значительных
количеств (1-10 мг) белка в пробе. Предлагаются биуретовые микрометоды,
основанные на поглощении ультрафиолетовых лучей медно-белковыми комплексами:
они позволяют определять 0.1 - 2.0 мг белка в пробе. Число небелковых веществ,
которые могут влиять на определения с помощью биуретовой реакции, невелико, но
следует вносить поправки на те вещества, которые присутствуют в высоким
концентрациях (соли аммония, сахароза). Наиболее ценными являются те
фотометрические методы, которые позволяют следить во времени за ходом
ферментативной реакции без ее прекращения по изменению окраски хромогенного
субстрата или добавленного индикатора. Метод Фолина и Чиокальто, предложенный
для определения количества белка, основан на хромогенной природе некоторых
боковых групп аминокислот, а также на присутствии в белках пептидных связей.
Этот метод обладает высокой чувствительностью (на пробу достаточно 0.01 - 0.1
мг белка), но многие небелковые вещества мешают определению.
В настоящее время для определения количества белка широко пользуются
измерениями интенсивности поглощения света при 280 нм, которое обусловлено
присутствием в белке ароматических аминокислот. Количество этих аминокислот в
разных белках различно и ,следовательно, интенсивность неодинакова. В кювете
толщиной 1 см у раствора, содержащего 1 мг “усредненного” белка в 1 мл,
оптическая плотность равна 1 при длине волны 280 нм. Нуклеиновые кислоты
поглощают при 280 нм, но можно сделать поправку на их присутствие, проводя
измерения и при 260 нм и при 280 нм. Очень важна быстрота измерения
активности ферментов. То же относится и к измерению количества сухого остатка
или количества белка. Тем самым предпочитают быстрый метод определения белка
путем измерения величины поглощения при 280 нм. Выигранное время важнее, за
счет того, что удельное поглощение выделяемого белка иногда значительно
отличается от средней величины поглощения смеси белков, присутствовавших в
исходном материале.
Манометрические методы. Эти методы используются при определении
активности фермента в тех случаях, когда в исследуемых реакциях один из
компонентов находится в газообразном состоянии. К таким реакциям относится
главным образом те, которые связаны с процессами окисления и
декарбоксилирования, сопровождающимися поглощением или выделением кислорода и
углекислоты, а также реакции, в которых выделение или связывание газа
происходит в результате взаимодействия продуктов ферментативного превращения с
добавленным в систему реактивом. Наблюдение за ходом реакции во времени
проводится в специальных приборах - манометрических аппаратах Варбурга.
Другие методы. Сюда относится обширный ряд методов, включающих
поляриметрию, вискозиметрию, потенцио- и кондуктометрические измерения и т.п.
Также определение активности можно выполнять, используя методы хроматографии и
электрофореза на бумаге. Эти методы высокочувствительны и специфичны, что
делает их во многих случаях незаменимыми; они позволяют значительно сократить
расход фермента на измерение активности, но не всегда применимы ввиду
продолжительности разделения веществ в процессе хроматографии (и
электрофореза).
Специальные методы определения активности пепсина и папаина. Пепсин и
папаин относятся к одной из наиболее многочисленных групп ферментов -
протеолитические ферменты (протеазы). Они принадлежат к классу гидролаз, к
подклассу пептидгидролаз и катализируют расщепление белков и полипептидов в
соответствии с уравнением :
R1CONHR2 + H2O ® R1COOH + H2NR2 ,
R1 и R2 - остатки аминокислот, ди- или полипептиды.
Т.е. протеазы катализируют расщепление пептидной связи
¾CO¾NH¾ .
Теперь немного подробнее о пептидгидролазах.
Подкласс пептидгидролаз делится на следующие группы:
1. аминопептидазы (a-аминоацилпептидгидролазы) катализируют гидролиз
полипептидов по месту пептидной связи, находящейся рядом со свободной аминной
группой.
действие
R1 фермента R2
| ¯ |
H2N ¾ C ¾ C ¾ NH ¾ C ¾ C ¾
| ║ | ║
H O H O
2. карбоксипептидазы (пептидиламинокислотные гидролазы) катализируют
расщепление полипептидов по месту пептидной связи, находящейся рядом со
свободной гидроксильной группой.
R
¯ |
¾CO¾NH¾C¾H
|
действие COOH
фермента
3. дипептидазы (дипептидгидролазы) катализируют гидролитическое расщепление
на свободные аминокислоты.
NH2CH2CONH¾CH2¾COOH + H2O ® 2CH2NH2COOH
глицил-глицин
гликолол
Дипептидазы расщепляют только такие пептидные связи, по соседству с которыми
находятся одновременно свободные карбоксильная и аминная группы. Большое
влияние на действие дипептидаз оказывает наличие a-водородных атомов,
находящихся у атомов углерода, связанных со свободной карбоксильной и аминной
группами. При замене этих атомов другими группировками активность ферментов
снижается или совсем исчезает.
4. протеиназы - (пептидилгидролазы) гидролизуют непосредственно белок. При
этом образуются полипептиды и свободные аминокислоты. К этой подгруппе
протеиназ принадлежит пепсин, трипсин, химотрипсин, папаин и др. В процессе
действия ферментов на субстраты решающую роль играет структура молекул
субстрата (соответствующая часть молекулы субстрата), в которой происходит
разрыв. Характер распада белковой молекулы на пептиды и аминокислоты зависит
от природы субстрата и внешних условий (рН, температуры и др.). В качестве
белковых субстратов используют желатин, гемоглобин, казеин, сывороточный
альбумин.
Методы определения активности протеолитических ферментов
Модификационный метод. Модификационный метод с применением субстрата
казеина основан на определении скорости ферментативной реакции гидролиза
субстрата под действием исследуемых протеолитических ферментов, содержащихся в
материале, взятом на анализ. Скорость реакции определяют по количеству
образовавшихся аминокислот - тирозина (a-амино-b-оксифенилпропионовая кислота)
и триптофана (a-амино-b-индолилпропионовая кислота), которые устанавливают
колориметрической реакцией с реактивом Фолина. Этим методом определяют
указанные аминокислоты как в свободном, так и в связанном состоянии.
По количеству тирозина и триптофана, содержащемуся в гидролизате, определяют
количество превращенного белка в процессе ферментативной реакции (из расчета
содержания в белке 6% тирозина и 1.8% триптофана). В основу расчета
активности протеолитических ферментов положена зависимость степени гидролиза
белка от числа единиц активности фермента, введенных в ферментативную
реакцию. На основе этой зависимости составляется график.
Поскольку в данном методе количество аминокислот, характеризующих количество
превращаемого белка, определяется по интенсивности окраски реакционных сред -
оптической плотности после реакции с реактивом, то в графике для простоты
расчета вместо количества превращенного белка ставится пропорциональная ему
оптическая плотность раствора. При составлении графика по оси абсцисс
откладывают число единиц фермента, введенное в ферментативную реакцию, а по
оси ординат - оптическую плотность, полученную после колориметрической
реакции с реактивом Фолина.
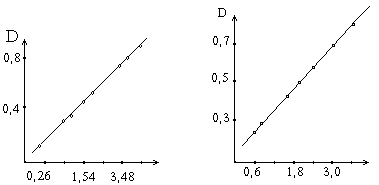
Содержание белка,мг Единицы активности
Зависимость оптической плотности от количества превращенного в процессе
Страницы: 1, 2, 3
|